EKSPERYMENT
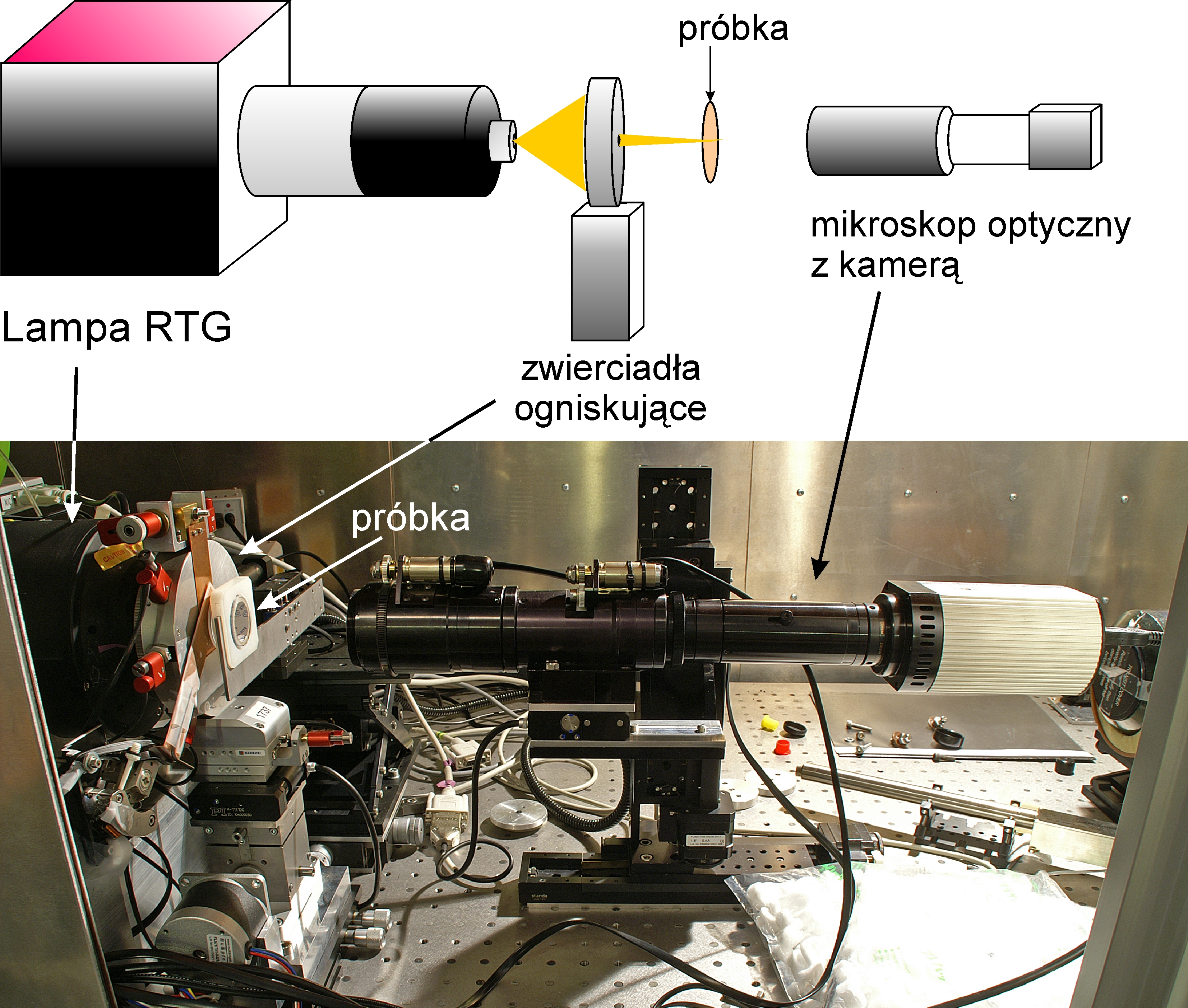
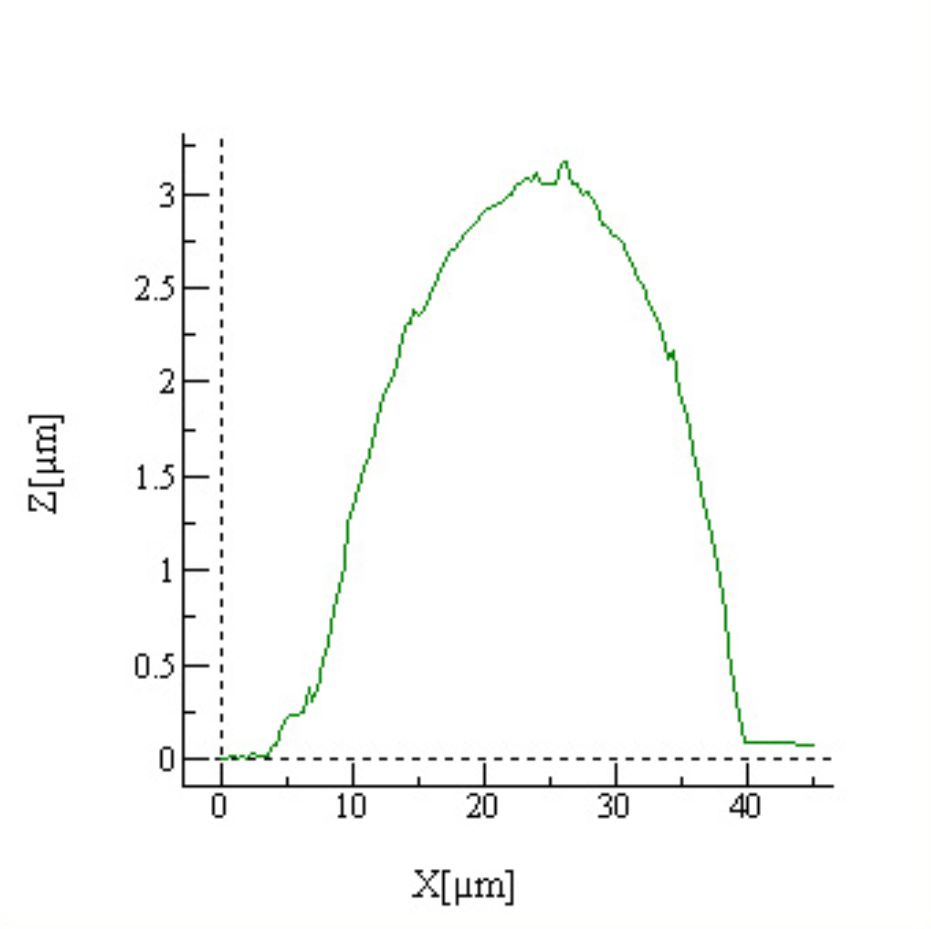
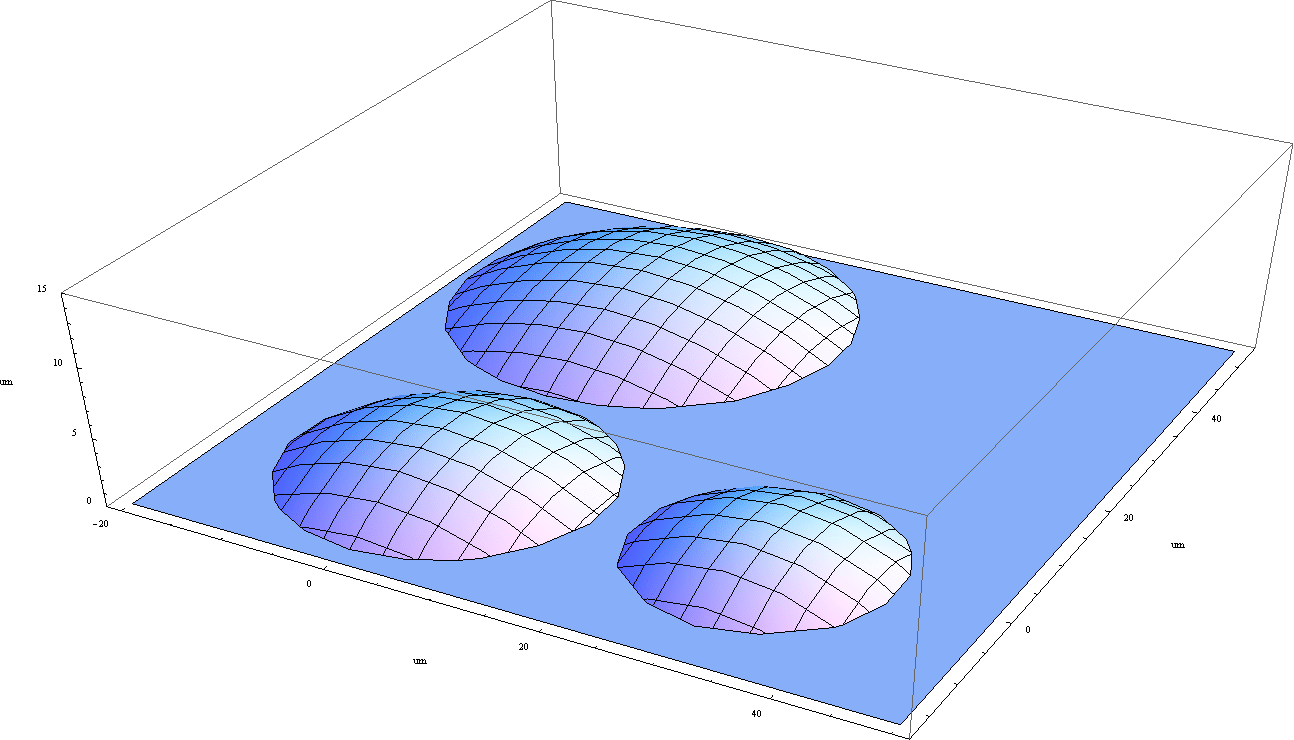
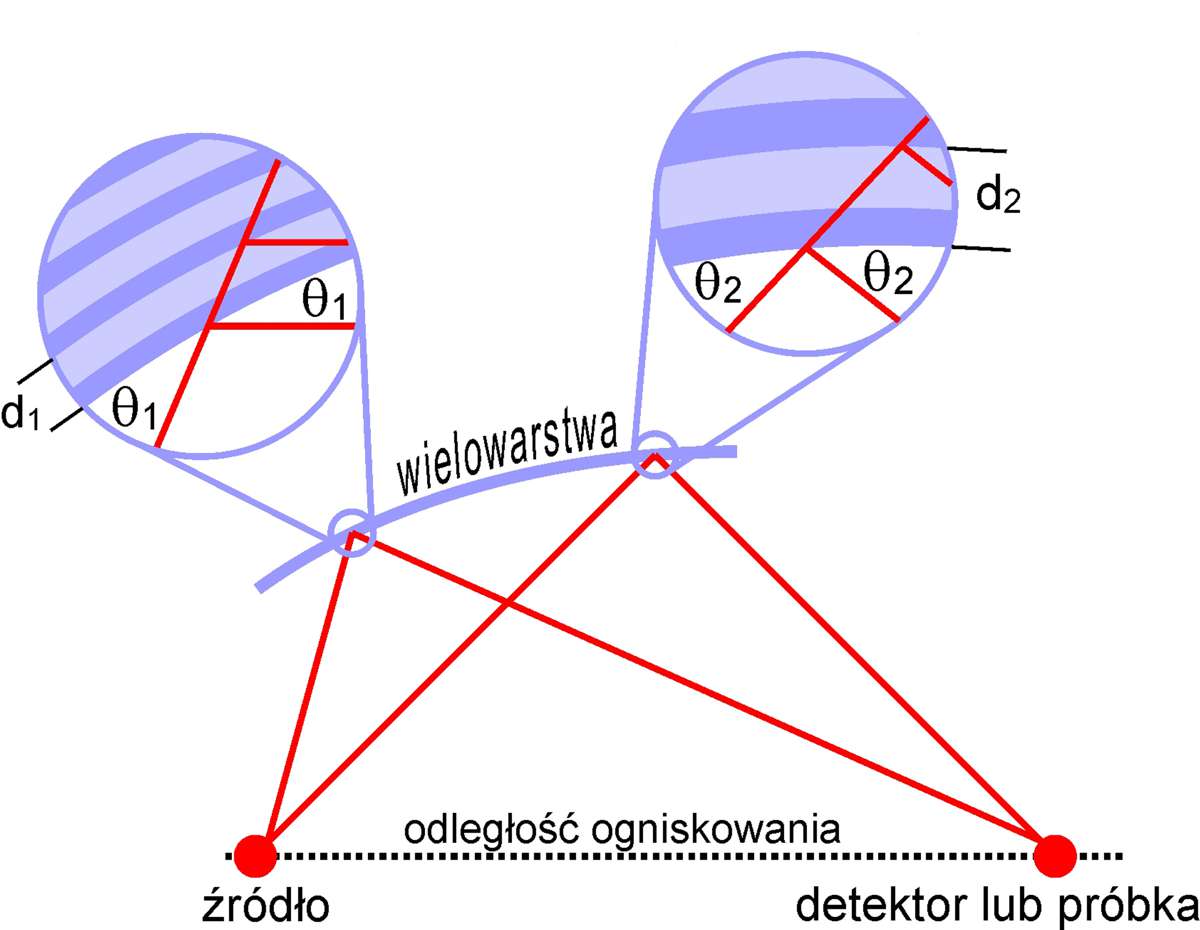
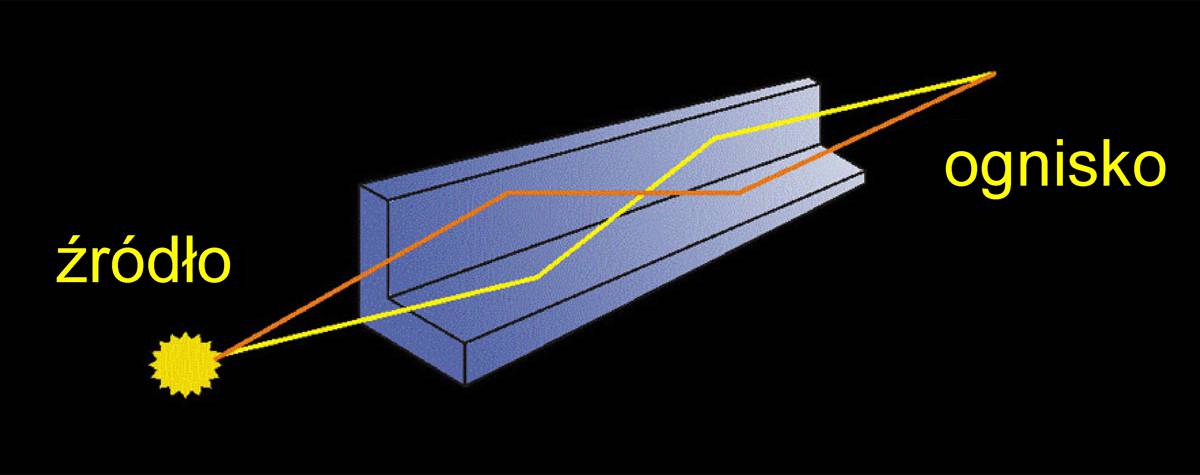
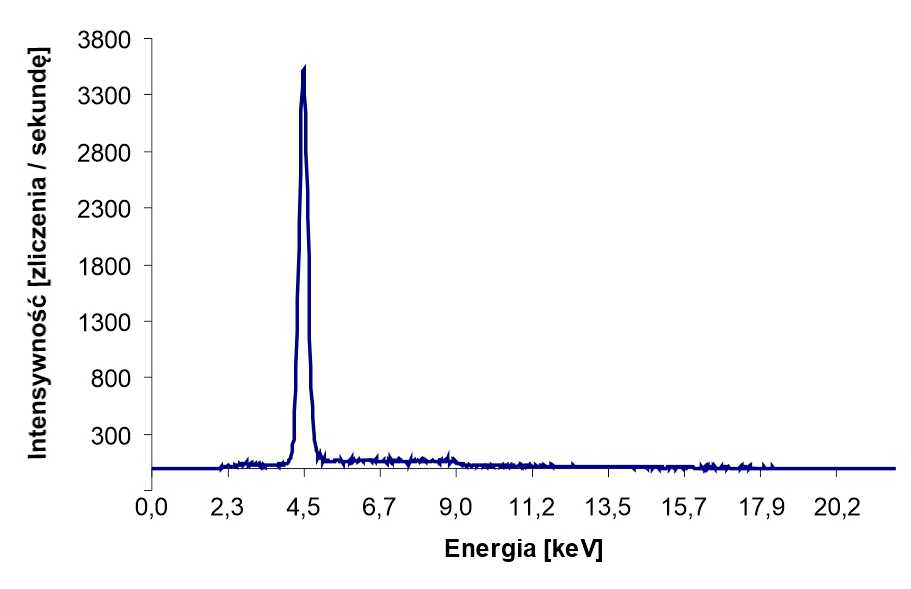
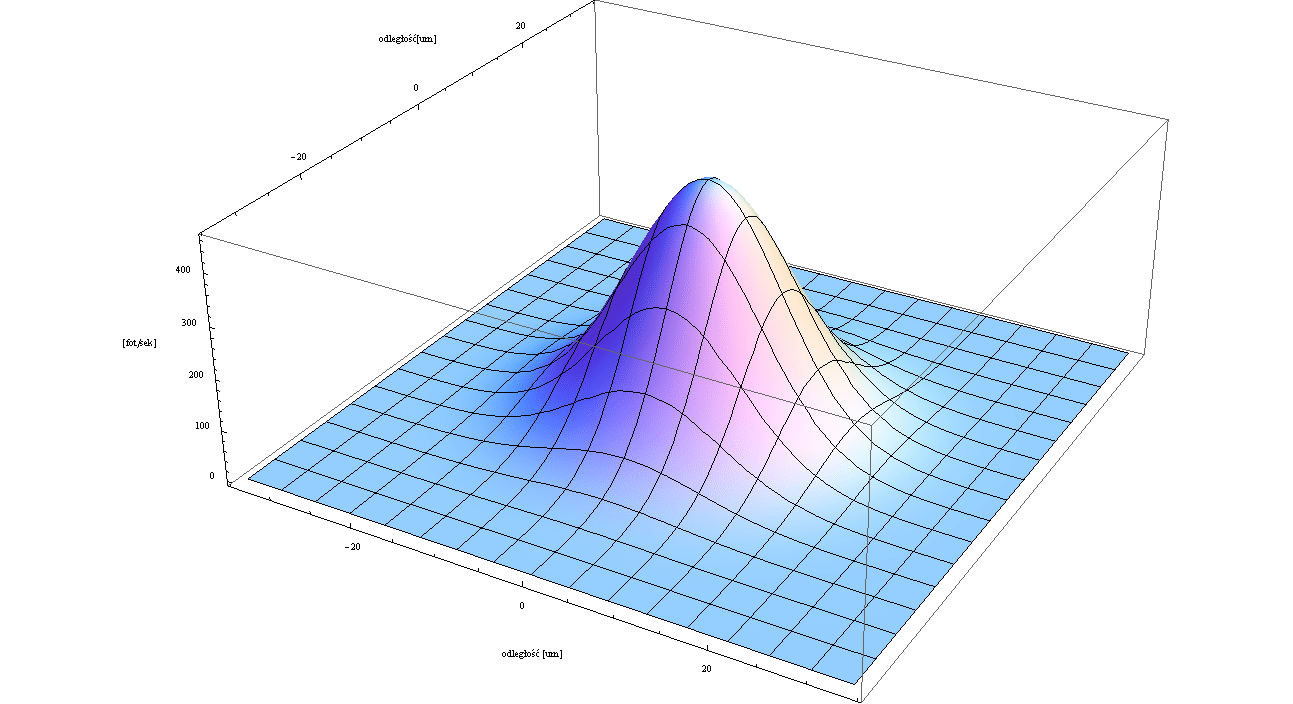
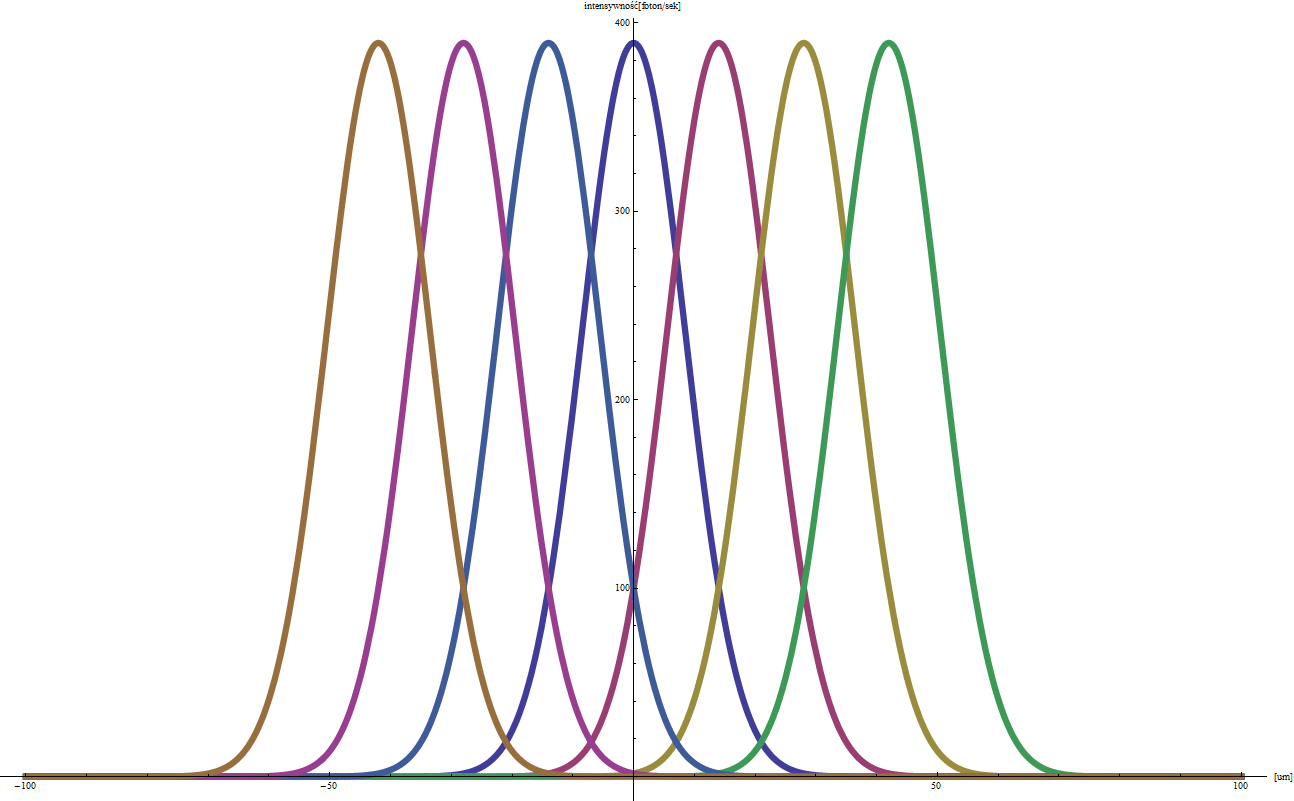
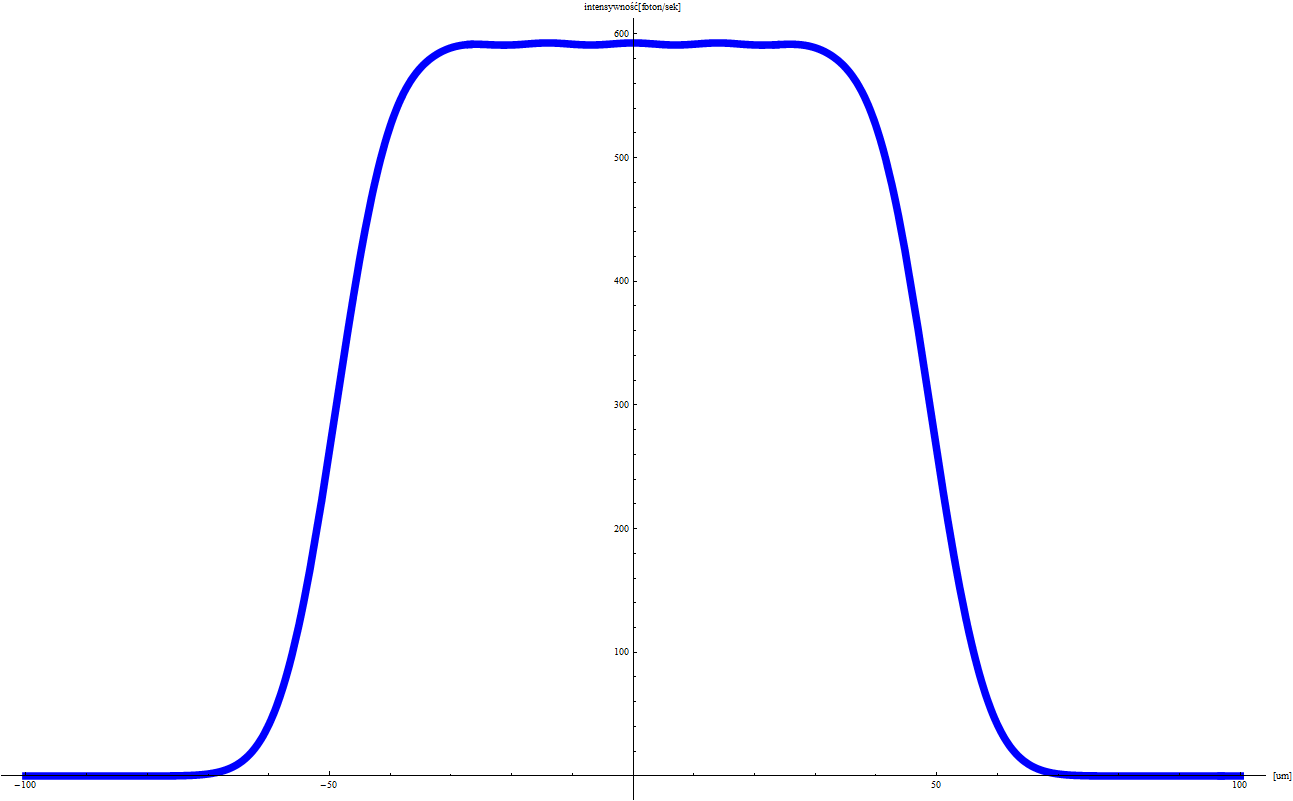
Stożkowa wiązka promieniowania z lampy rentgenowskiej wychodząca z obszaru o średnicy ok µm jest ogniskowana na próbce przez układ ogniskujący. Mikroskop optyczny umożliwia podgląd próbki i precyzyjne oznaczenie komórek przeznaczonych do napromieniowania. Dwa silniki krokowe poruszają próbką w płaszczyźnie ogniskowania wiązki. Miedziana przesłona (shutter) zapewnia precyzyjny czas naświatlania.
Komórki znajdują się na folii Mylarowej w otworze wydrążonym w szalce Petriego.

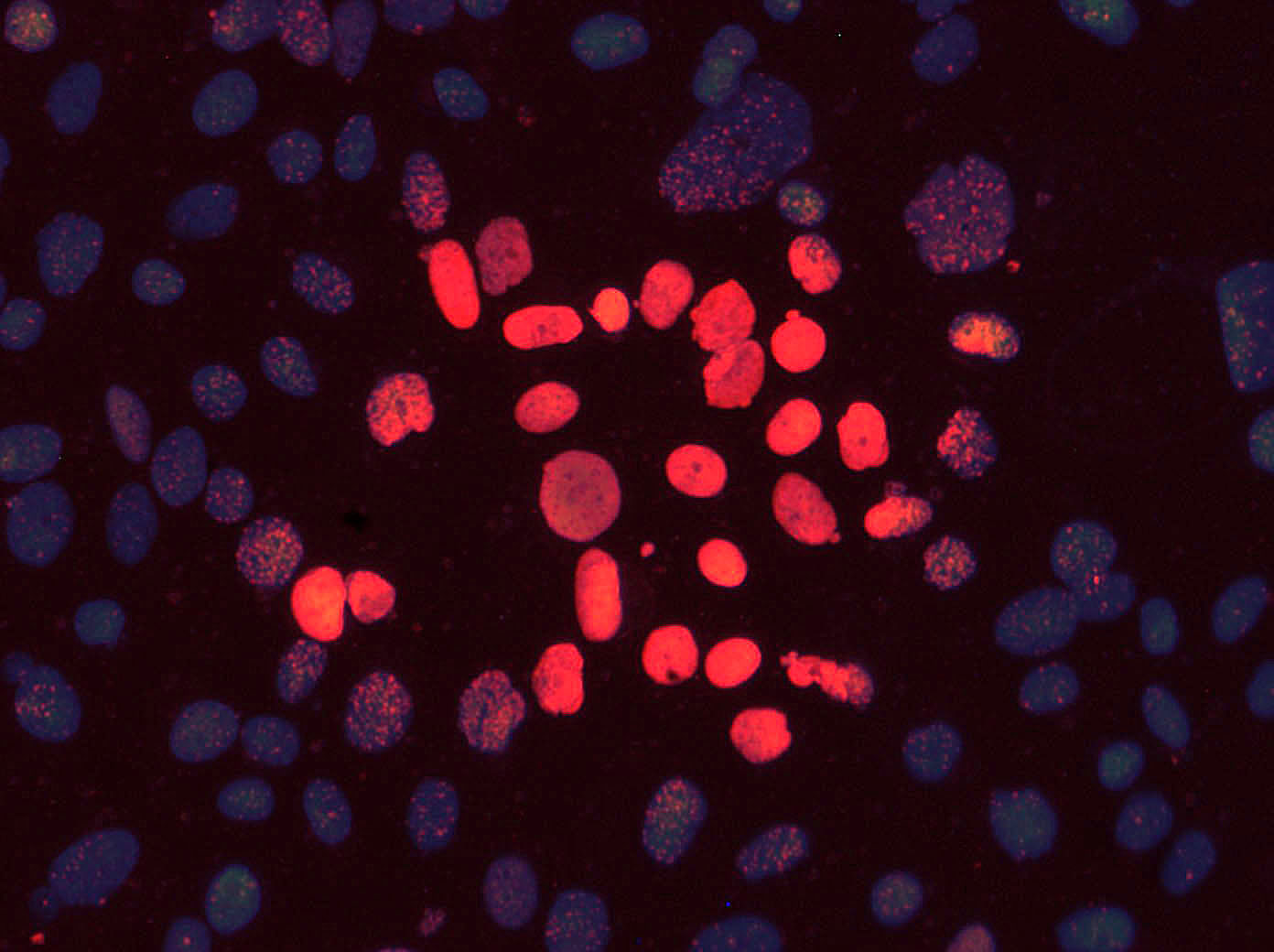
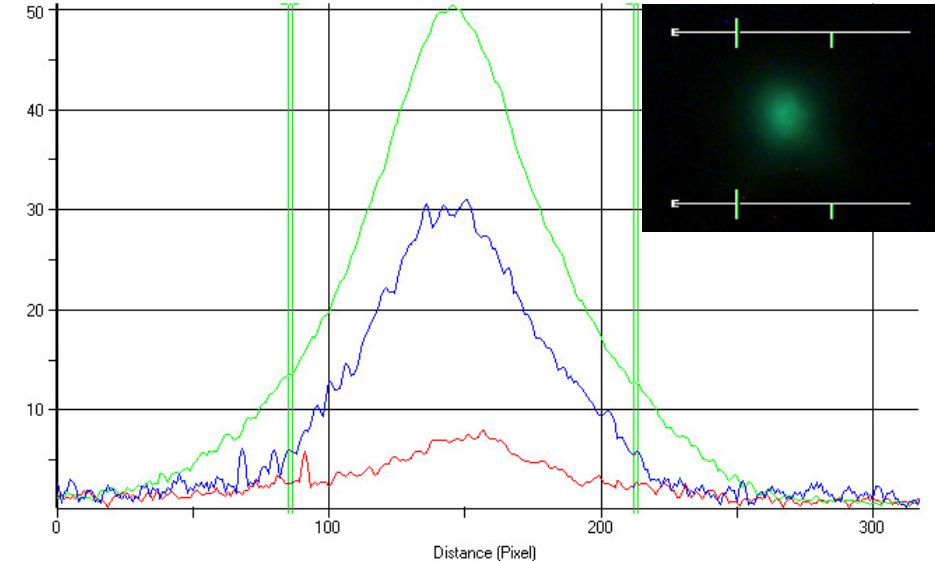
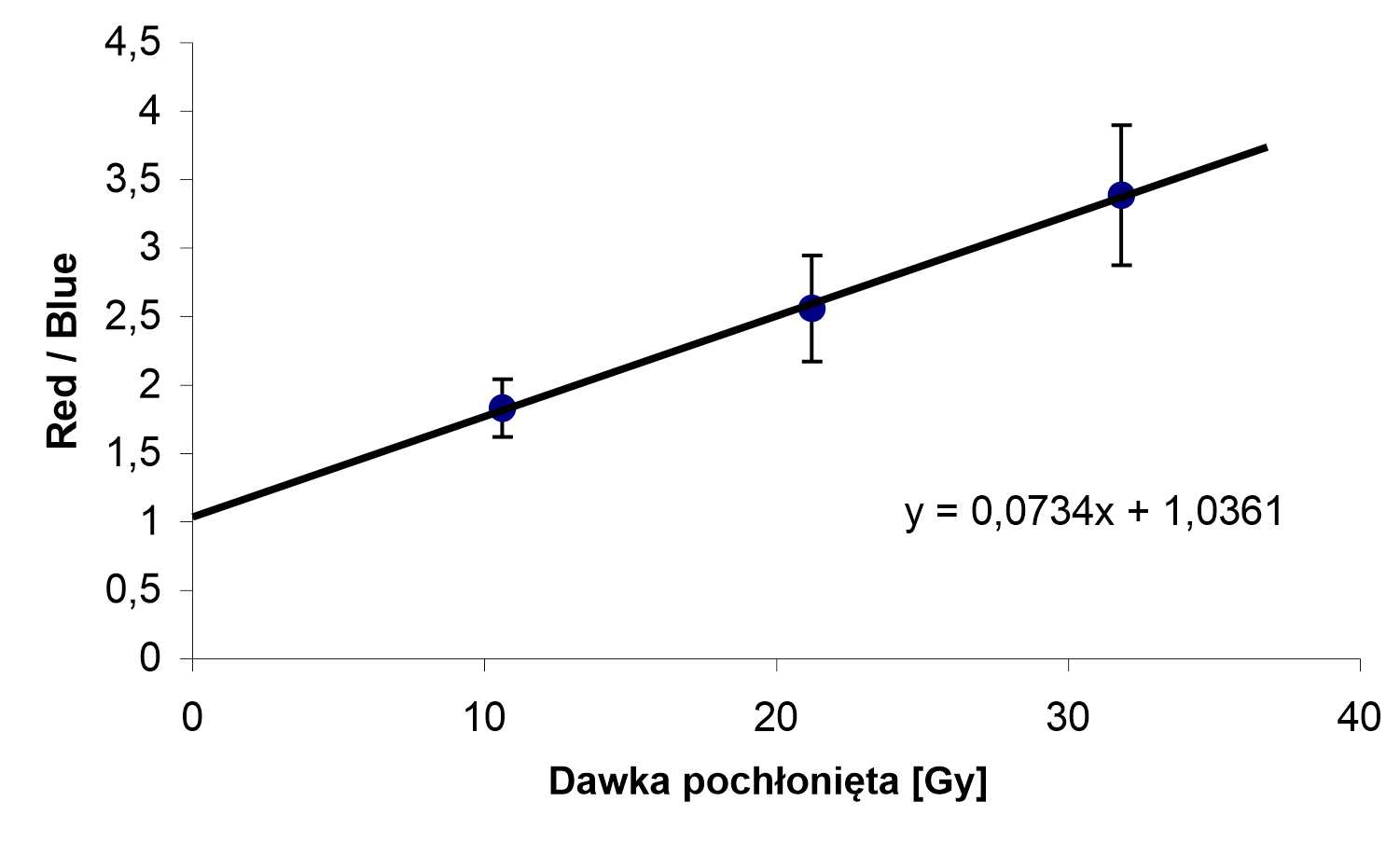
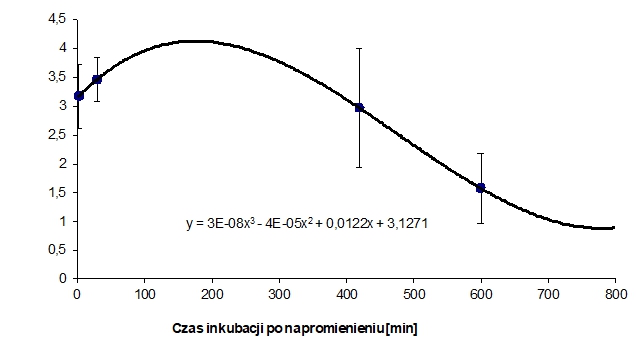
Po napromieniowaniu komórki są analizowane. Dla wizualizacji wszystkich komórek stosowany jest barwnik fluorescencyjny DAPI (4',6-diamidyno-2-fenyloindol), który przenika także przez nienaruszone błony komórkowe wiążąc się z DNA komórek. Wzbudzony światłem UV emituje on światło o barwie niebieskiej. Dla wizualizacji podwójnych uszkodzeń DNA w komórkach, stosowany jest barwnik Alexa Fluor 488, który wzbudzony światłem o długości fali 488 nm świeci na czerwono. Nałożenie tych dwóch obrazów daje wizualizację jąder komórkowych oraz powstałych w nich podwójnych uszkodzeń DNA.